* Reação Endotérmica
É aquela que absorve calor do meio externo. É necessário fornecer calor.
* Reação Exotérmica
É aquela que libera calor para o ambiente.
Ex: Queima do gás de cozinha (C3H8 + 5O2 -> 3CO2 + 4H2O + calor).
Representação Gráfica
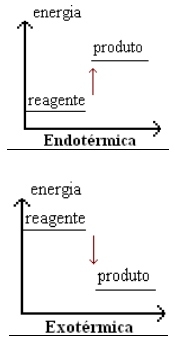
É o conteúdo global de calor de um sistema.
Unidade: Kcal ou KJ (1Kcal ~ 4,18KJ)
A variação da energia de um sistema (ΔH) pode ser calculado pela diferença entre as energias dos produtos e reagentes.
ΔH = Hprod – Hreag
*Reação endotérmica: Hprod > Hreag , ΔH > 0
*Reação exotérmica: Hprod < Hreag , ΔH < 0
Fatores que afetam a entalpia de uma reação
1 – Quantidade em mol de produtos e reagentes.
2 – Estado físico de produtos ou reagentes.
3 – Estado alotrópico de produtos ou reagentes. (alótropos = substância simples diferentes, formadas pelo mesmo elemento químico).
4 – Temperatura. Altas temperaturas fornecem reações endotérmicas e vice-versa.
Tipos de Entalpia
1 – Entalpia de formação (ΔH°f)
É o calor liberado ou absorvido na formação de 1 mol de uma substância no estado-padrão, a partir de substância simples.
Ex: Formação da Amônia = N2(g) + 3/2H2(g) -> NH3(g)
ΔH°f = -286KJ
2 – Entalpia de combustão (ΔH°C)
É o calor liberado na queima de 1 mol de uma substância no estado-padrão.
Ex: Queima do enxofre = S(s) + O2(g) -> SO2(g)
ΔH°C = -78 KJ/mol
Fonte:http://www.infoescola.com/quimica/termoquimica/
Exercícios de termoquímica
01)Dizemos que reações de combustão são exotérmicas porque:
a) absorvem calor.
b) liberam calor.
c) perdem água.
d) são higroscópicas.
e) liberam oxigênio.
02)Nas pizzarias há cartazes dizendo “Forno a lenha”. A reação que ocorre neste forno para assar a pizza é:
a)
explosiva.
b)
exotérmica.
c)
endotérmica.
d) hidroscópica.
e) catalisada.
03)Nos motores de explosão existentes hoje em dia utiliza-se uma mistura
de gasolina e etanol. A substituição de parte da gasolina pelo etanol foi
possível porque ambos os líquidos:
a) reagem exotermicamente com o oxigênio.
b) fornecem produtos diferentes na combustão.
c) são comburentes.
d) possuem densidades diferentes
.e) apresentam pontos de ebulição iguais.
04)Éter é normalmente usado para aliviar dores provocadas por contusões
sofridas por atletas, devido ao rápido resfriamento provocado, por esse líquido,
sobre o local atingido. Esse resfriamento ocorre porque:
a) o éter é um liquido gelado.
b) o éter, ao tocar a pele, sofre evaporação, e
este um processo endotérmico.
c) o éter reage endotermicamente com substâncias da pele.
d) o éter, em contato com a pele, sofre evaporação, e este é um processo
exotérmico.
e) o éter se sublima
05)Considere as seguintes transformações:
I . Dióxido de carbono sólido (gelo seco) }dióxido
de carbono gasoso.
II . Ferro fundido } ferro sólido.
III . Água líquida } vapor d’água.
Dessas transformações, no sentido indicado e à
temperatura constante, apenas:
a) I é exotérmica.
b) II é exotérmica.
c) III é exotérmica.
d) I e II são exotérmicas.
e) II e III são exotérmicas.
06)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos)
é [2] que a entalpia inicial(reagentes) e a variação de entalpia é [3] que
zero. Completa-se corretamente essa frase substituindo-se[1], [2] e [3],
respectivamente, por:
a) liberação, maior, maior.
b) absorção , maior, menor.
c) liberação, menor, menor.
d) absorção, menor, maior.
e) liberação, maior, menor.
07)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos)
é [2] que a entalpia inicial(reagentes) e a variação de entalpia é [3] que
zero. Completa-se corretamente essa frase substituindo-se[1], [2] e [3],
respectivamente, por:
a) liberação, maior, maior.
b) absorção, maior, menor.
c) absorção, maior, maior.
d) absorção, menor, maior.
e) liberação, maior, menor.
08)(UFMG-2002) Ao se sair molhado em local
aberto, mesmo em dias quentes, sente-se uma sensação de frio. Esse fenômeno está
relacionado com a evaporação da água que, no caso, está em contato com o corpo
humano. Essa sensação de frio explica-se CORRETAMENTE pelo fato de que a
evaporação da água
a)é um processo endotérmico e cede calor ao
corpo.
b) é um processo endotérmico e
retira calor do corpo.
c) é um processo exotérmico e cede calor ao
corpo.
d) é um processo exotérmico e retira calor do
corpo.
e) é um processo atérmico e não troca calor com
o corpo.
09) O conteúdo
energético de um sistema é denominado entalpia. Em uma reação endotérmica,
ocorre absorção de energia. Numa reação endotérmica, portanto, a entalpia dos
reagentes é;
a) maior ou igual à dos produtos.
b) menor que à dos produtos.
c) impossível de ser comparada
com a entalpia dos produtos.
d) igual à dos produtos.
e) e)maior que a dos produtos.
10)(UNISANTANA-SP) No
processo exotérmico, o calor é cedida ao meio ambiente, enquanto no processo
endotérmico o calor é absorvido do ambiente. Quando um atleta sofre uma
contusão, é necessário resfriar, imediatamente, o local com emprego de éter;
quando o gelo é exposto à temperatura ambiente, liquefaz-se. A evaporação do
éter e a fusão do gelo são, respectivamente, processos:
a) endotérmico e endotérmico.
b) exotérmico e exotérmico.
c) endotérmico e exotérmico.
d) exotérmico e endotérmico.
e) isotérmico e endotérmico.
Fonte:http://pt.scribd.com/doc/23286093/exercicios-termoquimica

Nenhum comentário:
Postar um comentário